Deslizá con el mouse sobre el mapa de ideas para ver la regulación de ambas vías.
También podés ponerlo en "Pantalla Completa", hacé click en "Play", regulá la velocidad y el zoom, y disfrutá de la animación.
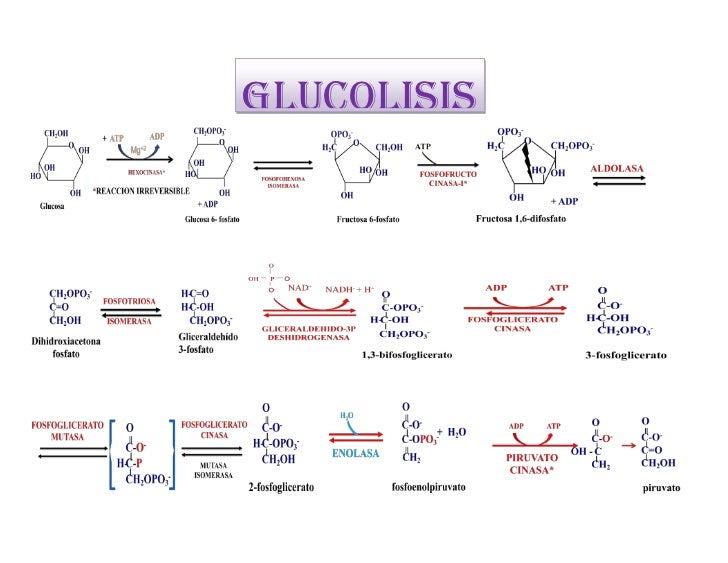
Glucólisis
Vía metabólica que se activa en post-ingesta por acción de la insulina del páncreas.
2)¿Qué órganos la utilizan?
Existen dos tipos:
-Insulino dependientes: Músculo y Tejido Adiposo.
Necesitan del transportador Glut-4 para poder captar Glucosa. Éste a su vez es inducido genéticamente por insulina.
-No insulino dependientes: Hígado, Cerebro, y eritrocitos.
Usan el transportador Glut-2 para captar Glucosa. No dependen de insulina para hacerlo.
En caso del Cerebro y los eritrocitos, tienen aporte exclusivo de Glucosa para obtener energía (no usan otra vía)porque no pueden oxidar otros componentes.
Eritrocitos: Carecen de mitocondrias para oxidar acidos grasos o cuerpos cetónicos.
Cerebro: Los Acidos Grasos no atraviesan la barrera hematoencefálica, en emergencias utilizan cuerpos cetónicos, que a la larga producen acidosis y no representan una solución viable durante el ayuno prolongado (ver más en Integración del Metabolismo).
3) Tipos de Glucólisis.
-Insulino dependientes: Músculo y Tejido Adiposo.
Necesitan del transportador Glut-4 para poder captar Glucosa. Éste a su vez es inducido genéticamente por insulina.
-No insulino dependientes: Hígado, Cerebro, y eritrocitos.
Usan el transportador Glut-2 para captar Glucosa. No dependen de insulina para hacerlo.
En caso del Cerebro y los eritrocitos, tienen aporte exclusivo de Glucosa para obtener energía (no usan otra vía)porque no pueden oxidar otros componentes.
Eritrocitos: Carecen de mitocondrias para oxidar acidos grasos o cuerpos cetónicos.
Cerebro: Los Acidos Grasos no atraviesan la barrera hematoencefálica, en emergencias utilizan cuerpos cetónicos, que a la larga producen acidosis y no representan una solución viable durante el ayuno prolongado (ver más en Integración del Metabolismo).
Aeróbica: La Glucosa se convierte en Piruvato.
Glucosa → Piruvato → Acetil-Coa → Esta ingresa a Krebs para oxidarse.
Requiere mitocondrias y oxígeno.
Anaeróbica: No requiere mitocondrias ni oxígeno. Ej: Eritrocitos, o el músculo en ejercicio (no se oxigena).
Los pasos son: Glucosa →Piruvato → Lactato. (Se libera NADH que irá a la cadena de transporte de electrones para obtener 2,5 ATPs).
4) Objetivos de la insulina en Glucólisis.
Glucosa → Piruvato → Acetil-Coa → Esta ingresa a Krebs para oxidarse.
Requiere mitocondrias y oxígeno.
Anaeróbica: No requiere mitocondrias ni oxígeno. Ej: Eritrocitos, o el músculo en ejercicio (no se oxigena).
Los pasos son: Glucosa →Piruvato → Lactato. (Se libera NADH que irá a la cadena de transporte de electrones para obtener 2,5 ATPs).
a- Disminuír los niveles de glucosa en sangre (hipoglucemiante).
b- Convertir la glucosa ingerida en energía química (ATP).
Para ello la glucosa se oxida a Piruvato, y este ingresará al Ciclo de Krebs convertido en Acetil-Coa.
5) Acciones de la insulina en Glucólisis.
b- Convertir la glucosa ingerida en energía química (ATP).
Para ello la glucosa se oxida a Piruvato, y este ingresará al Ciclo de Krebs convertido en Acetil-Coa.
~Inducción genética (estimula la síntesis de las tres enzimas clave de la glucólisis interactuando con factores de transcripcion como CREB y MAP kinasas).
~Regulación covalente: Activa la fosfodiesterasa que hidroliza AMPc. Al no haber AMPc, no se activa la enzima PKA que fosforila a muchas enzimas inactivándolas. Al no haber PKA, se desfosforila a la FFQ2 y por ende se activa. La FFQ2 produce uno de los reguladores alostéricos positivos para la FFQ1 de glucólisis, que a su vez inhibe a la gluconeogénesis inactivando a la Fosfatasa de la fructosa 1,6 bifosfato.
AMPc → PKA →fosforilo enzimas.
Fosfodiesterasa → Degrada AMPc:
AMPc → PKA → fosforilo enzimas → desfosforilo enzimas (porque no hay AMPc) →
activo FFQ2→ hay fructosa 2,6 bifosfato que:
-Inhibe la fosfatasa de la fructosa 1,6bifosfato (inhibe gluconeo)
-Estimula la FFQ1 (estimula glucolisis).
Esta regulación evita los ciclos fútiles: Son ciclos "inútiles" donde se gastaría energía realizando dos vías metabólicas que, en lugar de complementarse entre sí para el mismo objetivo, se cancelan. En este caso, si hiciésemos Glucólisis y Gluconeogénesis a la vez, estaríamos degradando glucosa y a su vez formando glucosa, entonces la glucemia nunca bajaría. La FFQ2, dando un alostérico positivo para una vía (glucolisis) y negativo para otra (gluconeo), está evitando un ciclo futil cancelando la vía opuesta a la que quiere favorecer.
6) Regulación de la Glucólisis.
~Regulación covalente: Activa la fosfodiesterasa que hidroliza AMPc. Al no haber AMPc, no se activa la enzima PKA que fosforila a muchas enzimas inactivándolas. Al no haber PKA, se desfosforila a la FFQ2 y por ende se activa. La FFQ2 produce uno de los reguladores alostéricos positivos para la FFQ1 de glucólisis, que a su vez inhibe a la gluconeogénesis inactivando a la Fosfatasa de la fructosa 1,6 bifosfato.
AMPc → PKA →fosforilo enzimas.
Fosfodiesterasa → Degrada AMPc:
activo FFQ2→ hay fructosa 2,6 bifosfato que:
-Inhibe la fosfatasa de la fructosa 1,6bifosfato (inhibe gluconeo)
-Estimula la FFQ1 (estimula glucolisis).
Esta regulación evita los ciclos fútiles: Son ciclos "inútiles" donde se gastaría energía realizando dos vías metabólicas que, en lugar de complementarse entre sí para el mismo objetivo, se cancelan. En este caso, si hiciésemos Glucólisis y Gluconeogénesis a la vez, estaríamos degradando glucosa y a su vez formando glucosa, entonces la glucemia nunca bajaría. La FFQ2, dando un alostérico positivo para una vía (glucolisis) y negativo para otra (gluconeo), está evitando un ciclo futil cancelando la vía opuesta a la que quiere favorecer.
A nivel de 3 enzimas:
a)Glucosa → Glucosa-6-fosfato (Glucoquinasa)
b) Fructosa-6-fosfato → Fructosa 1,6bifosfato (FFQ1)
c) Fosfoenolpiruvato → Piruvato (Piruvato Kinasa)
(¡Revisá la regulación alostérica de cada una en el mapa mental! Deslizando con el mouse en cada región)
Nota - Balance energético: La glucólisis da un total de entre 32 a 36 ATP's por la oxidación completa de una molécula de glucosa, luego de haber pasado por el ciclo de Krebs, cadena respiratoria y fosforilación oxidativa (ver en Ciclo de Krebs).
El proceso de glucosa → piruvato, gasta 2 ATP's. En esa etapa obtengo 4 ATPs gracias a la hidrólisis de uniones de alta energía. .
Por cada mol de glucosa obtengo un mol de DHAP y uno de G3P.
DHAP se convierte en G3p.
Por lo tanto, cada mol de glucosa netamente nos hace obtener 2 moles de G3P, y a partir de ahí, obtengo 4 ATPs en total (dos por cada G3P).(ver imagen al final del texto)
a)Glucosa → Glucosa-6-fosfato (Glucoquinasa)
b) Fructosa-6-fosfato → Fructosa 1,6bifosfato (FFQ1)
c) Fosfoenolpiruvato → Piruvato (Piruvato Kinasa)
(¡Revisá la regulación alostérica de cada una en el mapa mental! Deslizando con el mouse en cada región)
Nota - Balance energético: La glucólisis da un total de entre 32 a 36 ATP's por la oxidación completa de una molécula de glucosa, luego de haber pasado por el ciclo de Krebs, cadena respiratoria y fosforilación oxidativa (ver en Ciclo de Krebs).
El proceso de glucosa → piruvato, gasta 2 ATP's. En esa etapa obtengo 4 ATPs gracias a la hidrólisis de uniones de alta energía. .
Por cada mol de glucosa obtengo un mol de DHAP y uno de G3P.
DHAP se convierte en G3p.
Por lo tanto, cada mol de glucosa netamente nos hace obtener 2 moles de G3P, y a partir de ahí, obtengo 4 ATPs en total (dos por cada G3P).(ver imagen al final del texto)
Gluconeogénesis
Vía metabólica que se activa durante el ayuno por el glucagon del páncreas.
2)¿Qué organos la activan?
El hígado fundamentalmente (luego hay otros como el riñón).
3)Objetivos del Glucagon en gluconeogénesis.
-Convertir determinados sustratos en glucosa. El más comun: Piruvato.
-Permitir que los tejidos que necesitan glucosa puedan acceder a ella cuando no la hemos ingerido. Para ello, aumentaremos los niveles de glucemia. (Glucagon: Hiperglucemiante rápido) Recordar! Durante el ayuno no se libera insulina, con lo cual músculo y tejido adiposo no podrán hacer glucólisis, porque dependen de ella. Por lo tanto, para obtener glucosa usarán otras vías (por ejemplo: el musculo hará glucógenolisis, ver más adelante en Integración Metabólica).
Los tejidos no insulino dependientes, como el cerebro o los eritrocitos, durante el ayuno harán glucólisis para obtener energía, porque son no-insulinodependientes.
4)Sustratos usados para la gluconeogénesis.
-Permitir que los tejidos que necesitan glucosa puedan acceder a ella cuando no la hemos ingerido. Para ello, aumentaremos los niveles de glucemia. (Glucagon: Hiperglucemiante rápido) Recordar! Durante el ayuno no se libera insulina, con lo cual músculo y tejido adiposo no podrán hacer glucólisis, porque dependen de ella. Por lo tanto, para obtener glucosa usarán otras vías (por ejemplo: el musculo hará glucógenolisis, ver más adelante en Integración Metabólica).
Los tejidos no insulino dependientes, como el cerebro o los eritrocitos, durante el ayuno harán glucólisis para obtener energía, porque son no-insulinodependientes.
Sustratos que se pueden usar para formar Piruvato:
-Alanina (transdesaminación de aminoácidos, Ciclo de la Alanina):
alanina + alfa-cetoglutarato → piruvato + glutamato. (enzima GPT transaminasa)
-Lactato ( por el Ciclo de Cori) La enzima es la Lactato deshidrogenasa:
Lactato → Piruvato → Glucosa → Se libera a la sangre
Otros sustratos para la gluconeo:
-Glicerol (liberado en la B-oxidación de acidos grasos):Se convierte en G3P por la Glicerol Kinasa hepática e ingresa como intermediario en gluconeogénesis.
Es el intermediario que requiere menos energía porque ingresa en los pasos más adelantados de la vía. La reacción en la que ingresa es:
G3P + DHAP → fructosa 1,6 bifosfato.
-Malato (liberado en punto de fuga del Ciclo de Krebs).
-Aspartato(transdesaminación de aminoácidos): Se convierte en Oxalacetato que ingresa como intermediario. La reaccion es:
aspartato + alfa-cetoglutarato → oxalacetato + glutamato.
5) Acciones del Glucagon en gluconeogénesis.
-Alanina (transdesaminación de aminoácidos, Ciclo de la Alanina):
alanina + alfa-cetoglutarato → piruvato + glutamato. (enzima GPT transaminasa)
-Lactato ( por el Ciclo de Cori) La enzima es la Lactato deshidrogenasa:
Lactato → Piruvato → Glucosa → Se libera a la sangre
Otros sustratos para la gluconeo:
-Glicerol (liberado en la B-oxidación de acidos grasos):Se convierte en G3P por la Glicerol Kinasa hepática e ingresa como intermediario en gluconeogénesis.
Es el intermediario que requiere menos energía porque ingresa en los pasos más adelantados de la vía. La reacción en la que ingresa es:
G3P + DHAP → fructosa 1,6 bifosfato.
-Malato (liberado en punto de fuga del Ciclo de Krebs).
-Aspartato(transdesaminación de aminoácidos): Se convierte en Oxalacetato que ingresa como intermediario. La reaccion es:
aspartato + alfa-cetoglutarato → oxalacetato + glutamato.
~Inducción genética(estimula la síntesis de las tres enzimas clave de la gluconeogénesis interactuando con factores de transcripcion como CREB y MAP kinasas).
~Regulación covalente: El glucagon aumenta los niveles de AMPc activando la PKA, que Fosforila a la FFQ2 hepática. La enzima FFQ2 produce uno de los reguladores alostéricos positivos para la FFQ1, que a su vez inhibe a la gluconeogénesis inactivando a la Fosfatasa de la fructosa 1,6 bifosfato (repasar más arriba).
6) Regulación de la gluconeogénesis.
~Regulación covalente: El glucagon aumenta los niveles de AMPc activando la PKA, que Fosforila a la FFQ2 hepática. La enzima FFQ2 produce uno de los reguladores alostéricos positivos para la FFQ1, que a su vez inhibe a la gluconeogénesis inactivando a la Fosfatasa de la fructosa 1,6 bifosfato (repasar más arriba).
Alostéricamente a nivel de 3 enzimas:
a- Piruvato → Oxalacetato (Piruvato carboxilasa)
b- Fructosa 1,6bifosfato → Fructosa 6 fosfato (Fructosa1,6 bifosfatasa)
c- Glucosa 6 fosfato → Glucosa (Glucosa 6 fosfatasa)
a- Piruvato → Oxalacetato (Piruvato carboxilasa)
b- Fructosa 1,6bifosfato → Fructosa 6 fosfato (Fructosa1,6 bifosfatasa)
c- Glucosa 6 fosfato → Glucosa (Glucosa 6 fosfatasa)
Regulación General
Insulina – Mecanismo de acción.
Receptores de Insulina: Con actividad TIROSIN KINASA.
-El receptor puede autofosforilarse e iniciar cascadas de fosforilaciones, que tienen como finalidad activar a la fosfodiesterasa que hidrolizará AMPc, inactivando así a la PKA.
-Al no haber PKA, evito que ésta fosforile a las enzimas claves de las vías metabólicas que se activan en Postingesta (Glucólisis, Síntesis de Acidos Grasos, Síntesis de Colesterol, Lipogénesis).
-Al no poder fosforilar a estas enzimas clave, las vías se activarán y podrán cumplir su función: Disminuír los niveles de glucosa en sangre para evitar la hiperglucemia.
-Además, a traves de la cascada de fosforilaciones, interactua con factores de transcripción como CREB y MAP kinasas para poder inducir genéticamente la síntesis de las enzimas más importantes de estas vías.
Glucagon – Mecanismo de acción.
-El receptor puede autofosforilarse e iniciar cascadas de fosforilaciones, que tienen como finalidad activar a la fosfodiesterasa que hidrolizará AMPc, inactivando así a la PKA.
-Al no haber PKA, evito que ésta fosforile a las enzimas claves de las vías metabólicas que se activan en Postingesta (Glucólisis, Síntesis de Acidos Grasos, Síntesis de Colesterol, Lipogénesis).
-Al no poder fosforilar a estas enzimas clave, las vías se activarán y podrán cumplir su función: Disminuír los niveles de glucosa en sangre para evitar la hiperglucemia.
-Además, a traves de la cascada de fosforilaciones, interactua con factores de transcripción como CREB y MAP kinasas para poder inducir genéticamente la síntesis de las enzimas más importantes de estas vías.
Receptores de Glucagon: Acopados a Proteína Gs, que activará a la enzima Adenilato Ciclasa. La vía es:
Glucagon (prot GS) → AMPc →activará a la PKA → Acciones de la PKA:
a) Fosforilará e inactivará a las enzimas claves de las vías de la postingesta.
b) Fosforilará a otras enzimas activándolas durante el ayuno.
Nota: Hay enzimas que al estar fosforiladas se activan, que en general son las que participan de vías catabólicas, como las del ayuno. Ejemplos: la glucógeno-lisis y lipólisis (ver aparte cada vía).
Luego, otras enzimas al estar fosforiladas, se inactivan, que en general son las que participan de vías anabólicas, como las de posingesta. Ejemplos: Glucólisis, glucógeno-génesis.
c)La PKA activa cascadas de fosforilaciones que permiten la interacción con CREB y MAP kinasas para inducir genéticamente la síntesis de las enzimas claves de las vías del ayuno como Gluconeogénesis.
Glucagon (prot GS) → AMPc →activará a la PKA → Acciones de la PKA:
a) Fosforilará e inactivará a las enzimas claves de las vías de la postingesta.
b) Fosforilará a otras enzimas activándolas durante el ayuno.
Nota: Hay enzimas que al estar fosforiladas se activan, que en general son las que participan de vías catabólicas, como las del ayuno. Ejemplos: la glucógeno-lisis y lipólisis (ver aparte cada vía).
Luego, otras enzimas al estar fosforiladas, se inactivan, que en general son las que participan de vías anabólicas, como las de posingesta. Ejemplos: Glucólisis, glucógeno-génesis.
c)La PKA activa cascadas de fosforilaciones que permiten la interacción con CREB y MAP kinasas para inducir genéticamente la síntesis de las enzimas claves de las vías del ayuno como Gluconeogénesis.
*El cortisol, durante las primeras horas de la mañana, nos ayuda a obtener energía durante el ayuno. ¿Por qué?
Porque el cortisol también induce genéticamente al aumento de la síntesis de las enzimas de la gluconeogénesis, como lo hace el Glucágon
*Obtener glucosa en este momento es crucial para aquellos tejidos que la necesitan específicamente, como el cerebro, o los eritrocitos que no pueden usar otro combustible ¿Por qué?
Porque por la barrera hematoencefálica, solo pasan Glucosa y cuerpos cetónicos, no ácidos grasos. El eritrocito no tiene mitocondrias, su única fuente de energía será la glucosa, por la vía de glucólisis anaeróbica
*La grasa no puede convertirse en glucosa. Por lo tanto, consumir grasa durante el ayuno solo beneficiará a aquellos tejidos que puedan oxidarla en el Ciclo de Krebs para obtener energía, y la que no se use, se almacenará. Por qué?
Porque la reacción catalizada por la Piruvato deshidrogenasa es irreversible. Dicha reaccion es: Piruvato + coa + NAD →Acetil-coa + NADH
*Nuestro cuerpo está adaptado a sobrevivir por lo menos cinco días en situación de ayuno estricto. Por qué?
Esto se debe a que el cerebro puede oxidar cuerpos cetónicos que sí atraviesan la barrera hematoencefálica, y así obtener energía en reemplazo de la glucosa.
También el hígado hará gluconeogénesis para mantener los niveles de glucemia y asegurarle al cerebro y a los eritrocitos la carga de glucosa que necesitan.
También el hígado hará gluconeogénesis para mantener los niveles de glucemia y asegurarle al cerebro y a los eritrocitos la carga de glucosa que necesitan.
*La causa principal de muerte en ayuno prolongado, son las múltiples fallas en nuestros órganos (la glucemia está en valores normales). Por qué?
Esto se debe a que no se sintetizaron las proteínas necesarias para realizar las funciones vitales correspondientes, porque los aminoácidos han sido consumidos para fabricar glucosa. Recordemos que la fuente principal de glucosa, son los aminoácidos para fabricar piruvato.
Por eso, se recomienda durante el ayuno consumir preferiblemente hidratos de carbono que elevarán rápidamente los niveles de glucosa en sangre.
Elevando la glucemia, los tejidos no insulinodependientes podrán captarla de la sangre para obtener energía cuando aún no hemos ingerido alimento